Investigadors del CSIC, del CRAG i de la Universitat de Düsseldorf descriuen l'estructura d'un enzim, el DRL, essencial per a la supervivència d'alguns bacteris | El disseny de fàrmacs específics per inhibir l'enzim DRL en els patògens que la tenen permetrà un ús més selectiu dels antibiòtics
 El constant augment de la resistència dels bacteris als antibiòtics actuals està impulsant la investigació científica de cara a buscar noves dianes per atacar els bacteris patogènics. A més, es busca combatre específicament als microbis que causen la infecció sense afectar altres tipus de bacteris innocus o beneficiosos, com els del tracte digestiu.
El constant augment de la resistència dels bacteris als antibiòtics actuals està impulsant la investigació científica de cara a buscar noves dianes per atacar els bacteris patogènics. A més, es busca combatre específicament als microbis que causen la infecció sense afectar altres tipus de bacteris innocus o beneficiosos, com els del tracte digestiu.
Una de les estratègies més prometedores és la inhibició de la síntesi d'isoprenoides, un grup de compostos essencials per als bacteris que aquests organismes produeixen per una ruta inexistent en humans i animals. En concret, la inhibició de l'enzim DXR amb l'antibiòtic fosmidomicina ja s'està utilitzant en la lluita contra bacteris multi-resistents.
No obstant això, alguns bacteris no tenen l'enzim DXR sinó un totalment diferent, anomenat DRL.
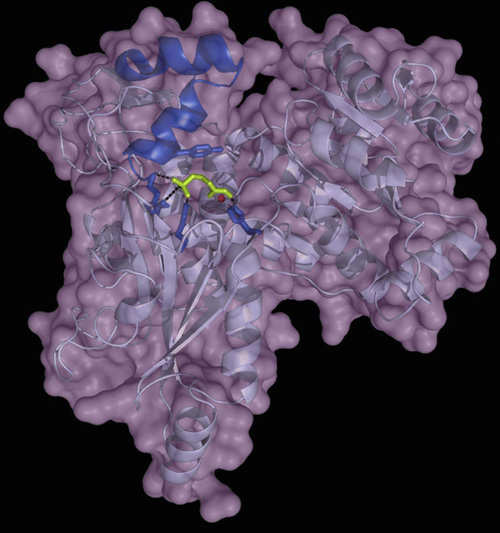
Un treball liderat per l'investigador del CSIC Manuel Rodríguez-Concepción al Centre de Recerca en Agrogenòmica (CRAG), ha desxifrat l'estructura d’aquest enzim DRL, aïllat del bacteri Brucella abortus, causant de la brucel·losi en el bestiar boví.
Els resultats, que es publiquen Journal of Biological Chemistry (JBC), demostren que es poden dissenyar fàrmacs específics per inhibir l'enzim DRL, el que permetria dissenyar antibiòtics que actuen de forma molt més selectiva i evitant la propagació de la resistència bacteriana, ja que la majoria de bacteris no té DRL sinó DXR.
A més del CRAG (consorci del CSIC, l'Institut de Recerca i Tecnologies Agroalimentàries, la Universitat Autònoma de Barcelona i la Universitat de Barcelona), en el treball han participat científics de l'Institut de Biologia Molecular de Barcelona, també del CSIC, i de la Universitat de Düsseldorf (Alemanya).
Estructures diferents però igual funció
Els investigadors han descobert que els enzims DXR i DRL tenen una estructura totalment diferent tot i que tenen la mateixa funció i desencadenen la mateixa reacció bioquímica. També han descobert que interactuen de forma diferent amb l'antibiòtic fosmidomicina i que, partint d'aquestes diferències, es poden dissenyar fàrmacs específics per als patògens que disposen de l'enzim DRL. Això permet un ús més restrictiu i selectiu dels antibiòtics.
Els fàrmacs dissenyats per inhibir l'enzim DRL, diuen els científics, "podrien ser usats com a antibiòtics de curt espectre", dirigits a un grup molt concret de patògens i que es podrien utilitzar en casos específics com la brucel·losi. Això evitaria usar els antibiòtics d'ampli espectre de forma innecessària. L'ús creixent d'antibiòtics d'ampli espectre és, de fet, una de les causes de l'augment de la resistència bacteriana als antibiòtics.
El treball, que es publica al número de maig del Journal of Biological Chemistry, ha estat seleccionat com "Paper of the Week" i destacat per la revista ASBMB Today.
Article de referència
Crystal structure of the Brucella abortus deoxyxylulose 5-phosphate reductoisomerase-like (DRL) enzyme involved in isoprenoid biosynthesis. Jordi Perez-Gil, Barbara M. Calisto, Christoph Behrendt, Thomas Kurz, Ignacio Fita, and Manuel Rodriguez-Concepcion (2012) J. Biol. Chem. May 4, Issue 19, Volume 287, pages 15803-15809
