Investigadores del CSIC, del CRAG y de la Universidad de Düsseldorf describen la estructura de una enzima, la DRL, esencial para la supervivencia de algunas bacterias | El diseño de fármacos específicos para inhibir la enzima DRL en los patógenos que la tienen permitirá un uso más selectivo de los antibióticos
 El constante aumento de la resistencia de las bacterias a los antibióticos actuales está impulsando la investigación científica de cara a buscar nuevas dianas para atacar las bacterias patogénicas. Además, se busca combatir específicamente a los microbios que causan la infección sin afectar a otros tipos de bacterias inocuas o beneficiosas, como las del tracto digestivo.
El constante aumento de la resistencia de las bacterias a los antibióticos actuales está impulsando la investigación científica de cara a buscar nuevas dianas para atacar las bacterias patogénicas. Además, se busca combatir específicamente a los microbios que causan la infección sin afectar a otros tipos de bacterias inocuas o beneficiosas, como las del tracto digestivo.
Una de las estrategias más prometedoras es la inhibición de la síntesis de isoprenoides, un grupo de compuestos esencial para las bacterias que estos organismos producen por una ruta inexistente en humanos y animales. En concreto, la inhibición de la enzima DXR con el antibiótico fosmidomicina ya se está usando para la lucha contra bacterias multi-resistentes.
Sin embargo, algunas bacterias no tienen la enzima DXR sino una totalmente diferente, denominada DRL.
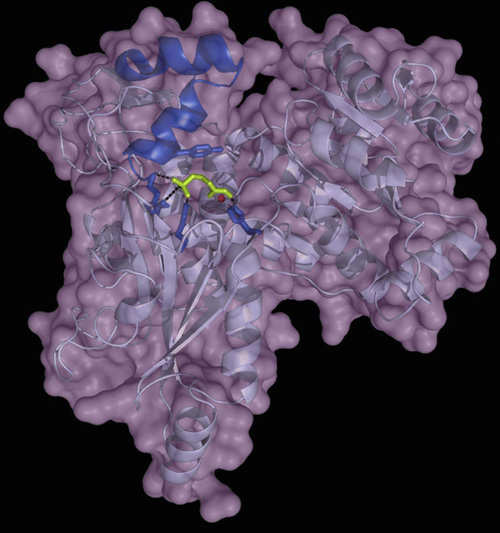
Un trabajo liderado el investigador del CSIC Manuel Rodríguez-Concepción en el Centro de Investigación en Agrogenómica (CRAG), ha descifrado la estructura de la enzima DRL, aislada de la bacteria Brucella abortus, causante de la brucelosis en el ganado vacuno.
Los resultados, que se publican Journal of Biological Chemistry (JBC), demuestran que se pueden diseñar fármacos específicos para inhibir la enzima DRL, lo que permitiría diseñar antibióticos que actúen de forma mucho más selectiva y evitando la propagación de la resistencia bacteriana, ya que la mayoría de bacterias no tiene DRL sino DXR.
Además del CRAG (consorcio del CSIC, del Instituto de Investigación y Tecnologías Agroalimentarias, la Universidad Autónoma de Barcelona y la Universidad de Barcelona), en el trabajo han participado científicos del Instituto de Biologia Molecular de Barcelona del CSIC, y de la Universidad de Düsseldorf (Alemania).
Estructuras diferentes pero idéntica función
Los investigadores han descubierto que las enzimas DXR y DRL tienen una estructura totalmente diferente a pesar de que tienen la misma función y desencadenan la misma reacción bioquímica. También han descubierto que interactúan de forma diferente con el antibiótico fosmidomicina y que, partiendo de esas diferencias, se pueden diseñar fármacos específicos para los patógenos que disponen de la enzima DRL. Eso permite un uso más restrictivo y selectivo de los antibióticos.
Los fármacos diseñados para inhibir la enzima DRL, dicen los científicos, “podrían ser usados como antibióticos de corto espectro”, dirigidos a un grupo muy concreto de patógenos y que se podrían usar en casos específicos como la brucelosis. Eso evitaría usar los antibióticos de amplio espectro de forma innecesaria. El uso creciente de antibióticos de amplio espectro es, de hecho, una de las causas del aumento de la resistencia bacteriana a los antibióticos.
El trabajo, que se publica en el número de mayo del Journal of Biological Chemistry, ha sido seleccionado como “Paper of the Week” y destacado por la revista ASBMB Today.
Articulo de referencia:
Crystal structure of the Brucella abortus deoxyxylulose 5-phosphate reductoisomerase-like (DRL) enzyme involved in isoprenoid biosynthesis. Jordi Perez-Gil, Barbara M. Calisto, Christoph Behrendt, Thomas Kurz, Ignacio Fita, and Manuel Rodriguez-Concepcion (2012) J. Biol. Chem. May 4, Issue 19, Volume 287, pages 15803-15809
